近年来,细菌胞外囊泡(Extracellular vesicles, EVs)作为一种新兴的基因水平转移方法已经成为人们研究的热点。EVs是由细胞产生和释放到细胞外环境中的膜性囊泡,由脂质双分子层包裹脂多糖、磷脂、核酸、蛋白质等物质形成的杯状纳米颗粒,直径通常为 20-200 nm,EVs在基因转移、促进病原菌致病、协助细菌在应激条件存活以及调节细菌相互作用等方面发挥着重要作用。
近日,伟德betvlctor体育官网王红宁教授研究团队在国际权威期刊International Journal of Antimicrobial Agents(2023 IF:10.8)和 Journal of Antimicrobial Chemotherapy分别发表题为 “ESBL- Escherichia coli extracellular vesicles mediate bacterial resistance to β-lactam and mediate horizontal transfer of blaCTX-M-55” (DOI: 10.1016/j.ijantimicag.2024.107145)和“Membrane vesicles derived from Enterococcus faecalis promote the co-transfer of important antibiotic resistance genes located on both plasmids and chromosomes”(DOI: 10.1093/jac/dkad381)的研究论文,证明EVs可以将耐药基因从一种病原菌传播给多种病原菌,同时可以介导位于质粒和染色体上的耐药基因转移,促进了耐药基因在不同细菌间的散播,对细菌耐药性传播提供了新的认识。
发表在《International Journal of Antimicrobial Agents》期刊上题为 “ESBL- Escherichia coli extracellular vesicles mediate bacterial resistance to β-lactam and mediate horizontal transfer of blaCTX-M-55”的研究论文发现产超广谱β-内酰胺酶大肠杆菌(ESBL-E.coli)的EVs可以介导细菌对β-内酰胺耐药并介导blaCTX-M-55的水平转移,该研究证明了EVs在ESBL-E.coli β-内酰胺耐药传播中起着重要作用,提高了耐药基因水平传播的风险。
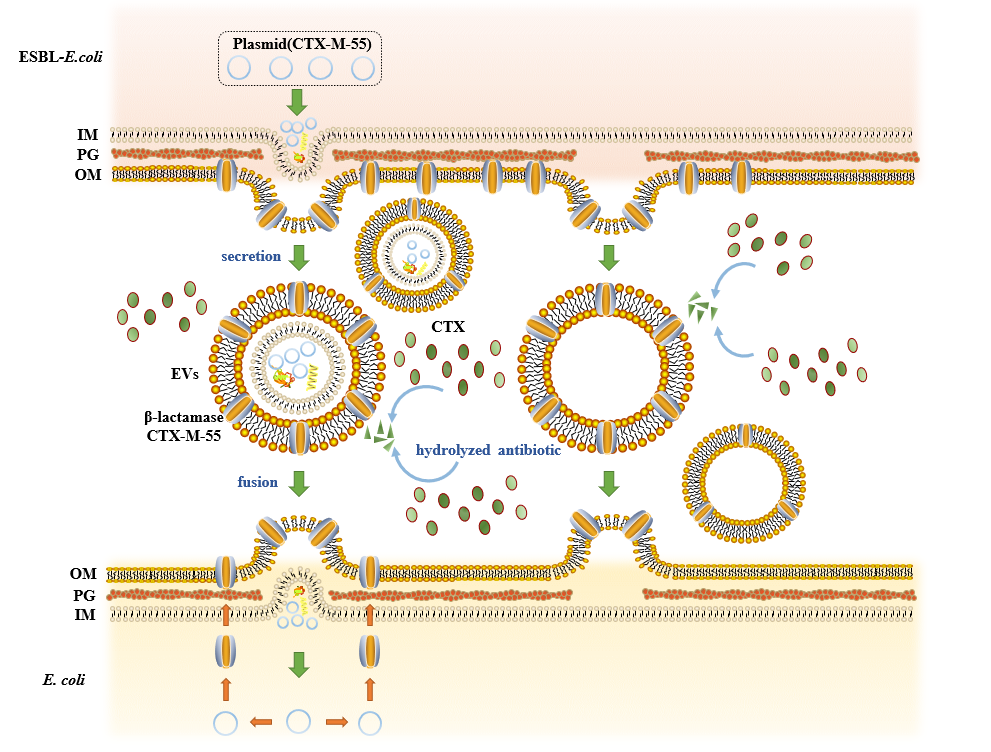
该研究以多种携带blaCTX-M-55耐药基因的ESBL-E.coli的EVs为研究对象,对 EVs 在大肠杆菌 β-内酰胺耐药性传播中的作用开展评估。结果表明ESBL-EVs 可以在β-内酰胺抗生素存在的情况下保护敏感菌免受抗生素影响,并且这种保护作用依赖于 EVs 的完整性,呈现出EVs剂量和时间依赖效应。
同时研究表明EVs 介导的基因水平转移是一种比较普遍的转移途径,多种携带不同质粒类型的 ESBL-E.coli的EVs可以介导blaCTX-M-55 的水平转移,转移频率基本在10-5-10-7之间。但这种转移具有一定的选择性,会更倾向于在亲缘关系更近的种属中进行。该研究为阐明EVs介导的耐药传播新机制提供了理论依据。
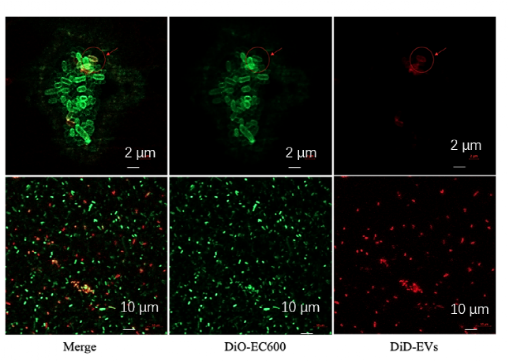
EVs 与受体菌 EC600 发生融合。其中EC600被DiO染料染成绿色,EVs被DiD染料染成红色
尽管EVs介导耐药基因水平转移近几年已在多种细菌和耐药基因中被报道,但研究对象主要集中在革兰氏阴性菌,对于革兰氏阳性菌的囊泡介导耐药基因转移的研究几乎没有。王红宁教授团队首次发现囊泡也能在革兰氏阳性菌中介导耐药基因转移。
近日在《Journal of Antimicrobial Chemotherapy》期刊上发表的题为“Membrane vesicles derived from Enterococcus faecalis promote the co-transfer of important antibiotic resistance genes located on both plasmids and chromosomes”的研究论文首次报道了革兰氏阳性菌粪肠球菌的MVs介导携带ARGs的质粒和转座子的共同转移,这一发现大大扩展了目前已知的肠球菌的水平基因转移机制。
该研究选择猪源耐利奈唑胺粪肠球菌CQ20作为膜囊泡(Membrane Vesicles,MVs)的供体菌株,选择人源利奈唑胺敏感粪肠球菌SC032、屎肠球菌BM4105和大肠杆菌作为受体菌株。通过WGS或PCR证明了CQ20、MVs和获得ARGs的囊泡转化子中存在质粒(pCQ20-1和pCQ20-2)和携带optrA耐药基因的转座子Tn6674,并成功实现了CQ20-MVs中的质粒pCQ20-1和pCQ20-2以及转座子Tn6674向粪肠球菌SC032和屎肠球菌BM4105中的转移,但不能向大肠杆菌中转移,进而证明了粪肠球菌MVs可以介导ARGs从动物源性肠球菌转移到人源性肠球菌,而无法从革兰氏阳性菌转移到革兰氏阴性菌这一结论。同时实验也证明了通过囊泡获得ARGs的囊泡转化子仍然能够通过MVs继续传播这些ARGs。该研究为MVs在肠球菌中介导耐药基因的传播提供了新证据。
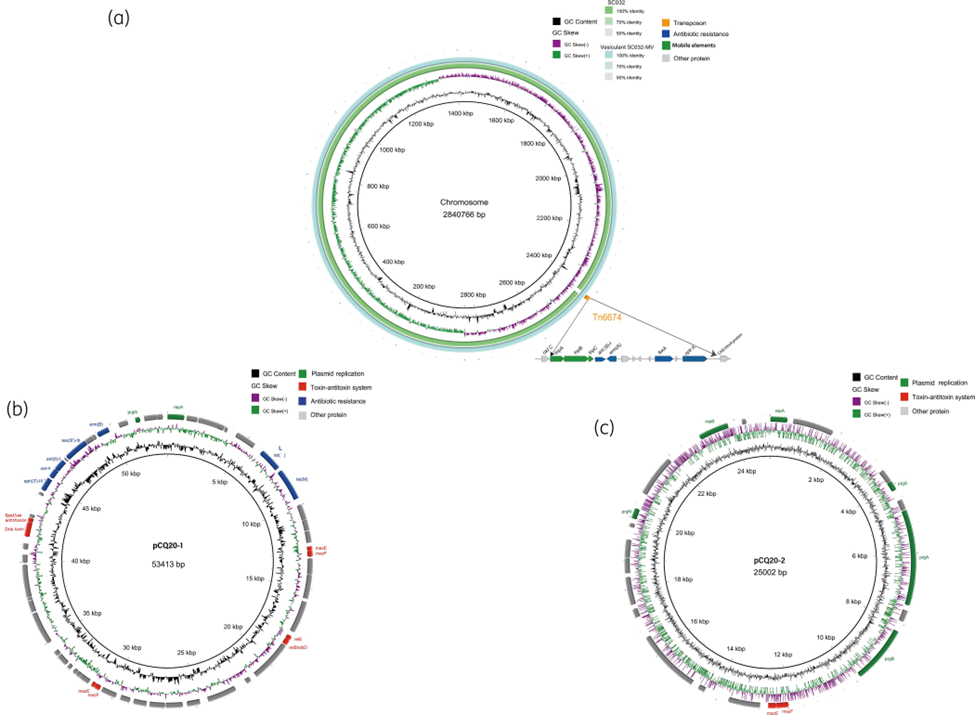
获得ARGs的囊泡转化子SC032-MVs中ARGs的遗传环境
伟德betvlctor体育官网硕士研究生徐荷婷、赵蒙宇分别为两篇论文的第一作者,王红宁教授、唐艺芝副教授分别为通讯作者,雷昌伟副研究员,博士生李超、李金朋、韩蕴、文仁桥,硕士生陈兴贵、林小龙共同参与了研究。研究得到了国家自然科学基金重点项目、区域联合基金重点项目、自然基金面上项目(31830098 、32273061、U21A20257)国家重点研发计划(2022YFC2303900)等资助。
参考文献:ESBL- Escherichia coli extracellular vesicles mediate bacterial resistance to β-lactam and mediate horizontal transfer of blaCTX-M-55. Int J Antimicrob Agents. 2024 Mar 16;63(5):107145. doi: 10.1016/j.ijantimicag.2024.107145.
Membrane vesicles derived from Enterococcus faecalis promote the co-transfer of important antibiotic resistance genes located on both plasmids and chromosomes. J Antimicrob Chemother. 2024 Feb 1;79(2):320-326. doi: 10.1093/jac/dkad381.
